4月4日,临床阶段的基因编辑公司iECURE宣布,FDA已批准其领先项目ECUR-506治疗鸟氨酸氨甲酰转移酶(Ornithine Transcarbamylase, OTC)缺乏症的IND申请。ECUR-506将在OTC-HOPE研究中进行评估,用于治疗新生儿OTC缺乏症患者。

iECUR目前聚焦治疗罕见儿科肝脏疾病的体内基因插入疗法(gene insertion therapies)。ECUR-506由宾夕法尼亚大学的James M. Wilson教授实验室开发,由递送不同载荷的两个AAV载体组成,一个载体递送ARCUS®核酸酶,目标是在已充分表征的PCSK9基因位点上进行基因编辑;另一个载体负责递送所需的功能性OTC基因(PCSK9上的切割位点作为OTC基因的插入位点)。
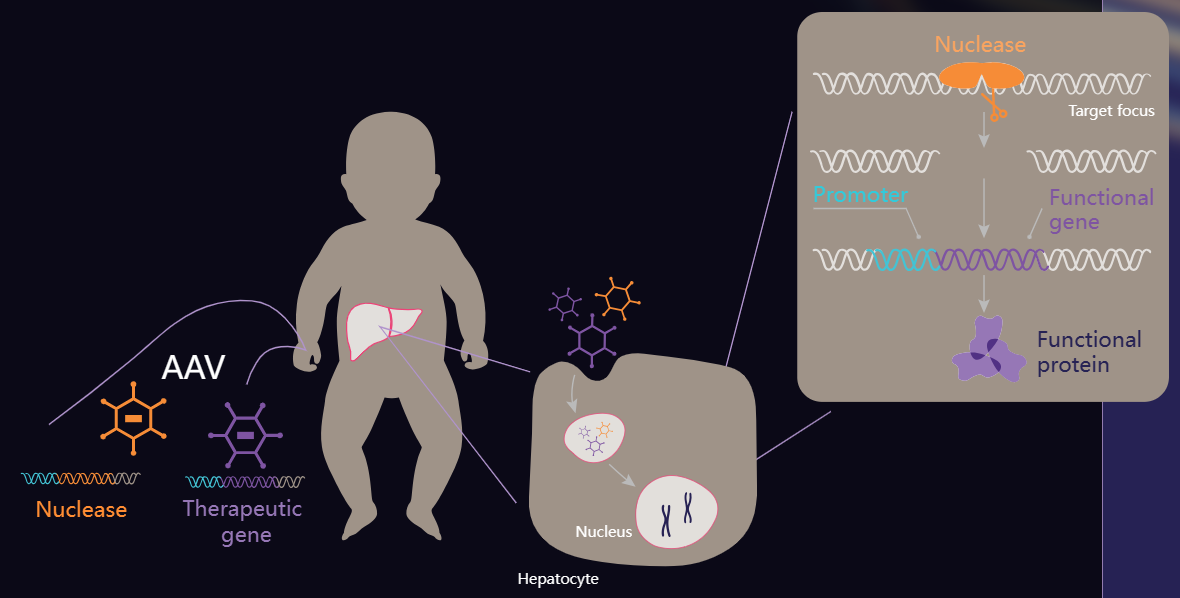 来源:公司官网
来源:公司官网
OTC-HOPE是一项针对OTC缺乏症男性新生儿患者的首次人体临床试验(I/II期,招募7个月以下被确诊为严重新生儿OTC缺乏症的男婴),此前已在英国和澳大利亚获批开展临床。该研究的主要终点是评估单剂量静脉给药后ECUR-506的安全性和耐受性。次要终点是评估ECUR-506的药代动力学和疗效。此外,研究的探索性终点将评估疾病特异性生物标志物、发育里程碑和生活质量。
据称,ECUR-506是首个在美国被批准用于婴儿研究的体内基因插入项目,也代表了ARCUS®核酸酶第一次在临床中被用于插入功能基因。
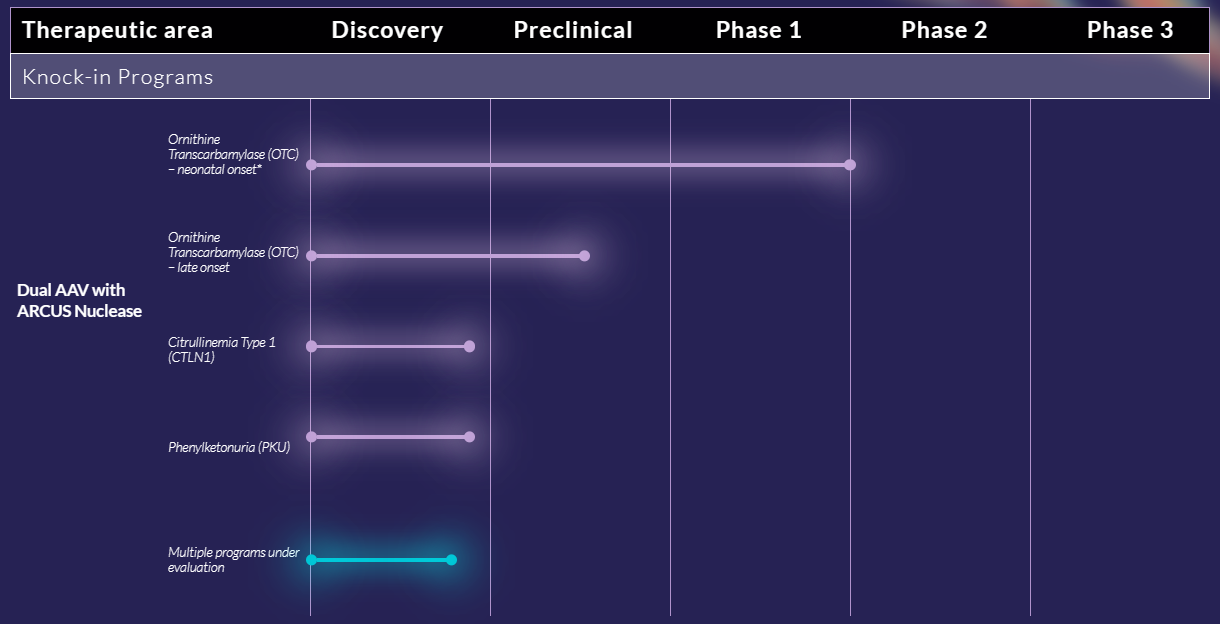
来源:公司官网
“对于许多孩子被诊断为新生儿OTC缺乏症的家庭来说,肝移植是唯一的治疗选择,但有严重风险,需要大量的免疫抑制治疗来防止移植排斥。ECUR-506代表了儿童在不需要移植的情况下长期产生功能性OTC酶的希望。”iECURE首席医学官Gabriel M. Cohn博士说道。
参考资料:
[1]https://iecure.com/news/iecure-announces-fda-clearance-of-investigational-new-drug-application-for-ecur-506-to-initiate-otc-hope-trial-for-treatment-of-neonatal-onset-ornithine-transcarbamylase-deficiency-in-the-u-s/
[2]https://endpts.com/fda-greenlights-first-test-of-gene-editing-therapy-in-babies-from-jim-wilson-startup/