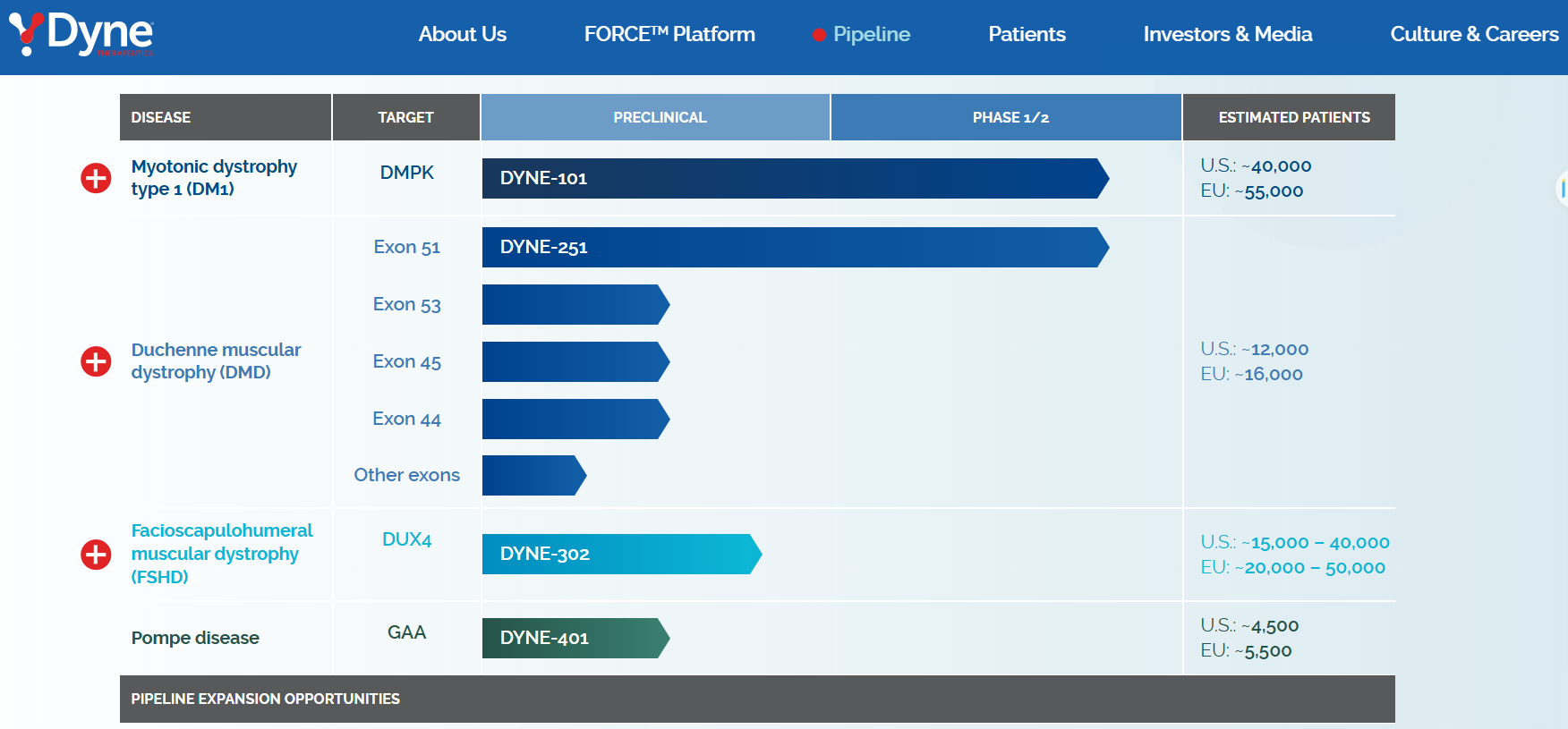
2025 年 8 月 4 日,Dyne Therapeutics公司宣布,美国食品和药物监督管理局 (FDA) 已授予 DYNE-251 突破性疗法称号,用于治疗适合外显子 51 跳跃的杜氏肌营养不良症 (DMD) 患者。该指定基于正在进行的 DELIVER 临床试验的数据。DYNE-251 已获得 FDA 的快速通道、孤儿药和罕见儿科疾病认定,以及欧洲药品管理局 (EMA) 的孤儿药认定,用于治疗 DMD。目前,公司已完成 DELIVER 试验注册扩展队列中 32 名患者的入组。该队列的数据计划于 2025 年底发布。预计2026年初将提交BLA以获得美国加速批准 。
DELIVER试验是一项全球性、随机、安慰剂对照、双盲、1/2期临床试验,旨在评估DYNE-251在DMD突变的患者中的安全性、耐受性和有效性(通过生物标志物和功能改善来衡量)适合外显子 51 跳跃的基因。该研究的多次递增剂量 (MAD) 部分导致选择每四个星期给药一次 20 mg/kg 的 DYNE-251 的注册剂量和方案。一个注册扩展队列已完全注册,以支持潜在的监管提交以获得美国加速批准。该队列的主要终点是 6 个月时通过蛋白质印迹测量的肌营养不良蛋白水平相对于基线的变化。
DYNE-251 由磷酸二酰胺吗啉寡聚物 (PMO) 与与转铁蛋白受体 1 (TfR1) 结合的抗原结合片段 (Fab) 偶联组成。它旨在使肌肉和中枢神经系统 (CNS) 产生近乎全长的肌营养不良蛋白,以改善功能。
FDA 授予突破性疗法称号,以加快旨在治疗严重疾病的药物的开发和审查,初步临床证据表明该药物可能在一个或多个具有临床意义的终点上表现出比现有疗法的显著改善。
Dyne 首席医疗官 Doug Kerr 医学博士表示:“DYNE-251 的突破性疗法称号证明了其作为下一代疗法的潜力,旨在为 DMD 患者带来有意义的功能改善,对于患者来说,外显子 51 跳跃可能导致产生近全长肌营养不良蛋白。“正如我们之前披露的那样,DYNE-251 在 18 个月内表现出持续的功能改善。接受20 mg/kg和10 mg/kg剂量治疗的患者在多个关键功能指标上显著改善,包括北极星步行评估(NSAA)、步速95百分位数(SV95C)、10米步行/跑步时间(10-MWR)及从地面起身时间。
Dyne Therapeutics是一家专注于为遗传驱动的神经肌肉疾病患者提供功能改善的临床阶段公司,正在开发针对肌肉和中枢神经系统 (CNS) 的疗法,以解决疾病的根本原因。该公司正在推进 1 型强直性肌营养不良症 (DM1) 和杜氏肌营养不良症 (DMD) 的临床项目,以及面肩肱型肌营养不良症 (FSHD) 和庞贝病的临床前项目。除了 DYNE-251 之外,Dyne 还正在建立全球 DMD 特许经营权,并拥有针对其他外显子(包括 53、45 和 44)的临床前项目。
每一个新药的研发上市并非一蹴而就,而是需要各利益相关方的不断努力。对于数万DMD 家庭而言,首先应该做好基本的日常护理和用药,而不只是被动等待。那些曾被断言 "20 岁前致命" 的生命,或许正在医学突破中获得与命运掰手腕的力量,而这本身,就是对所有坚持的最好回应。