当地时间2025年9月9日,Teva制药宣布美国食品药品监督管理局(FDA)已授予其研究性疗法emrusolmin(TEV-56286,Anle138b)用于治疗多系统萎缩(MSA)的快速通道资格认定。
Emrusolmin是一种靶向病理性α-突触核蛋白寡聚体的小分子药物。2021年10月Teva通过与德国MODAG 公司进行战略合作的方式引进了该产品,Teva获得开发、制造和商业化 Anle138b的全球独家许可。
2022年,FDA授予emrusolmin 孤儿药资格。目前一项2期临床试验正在评估emrusolmin治疗MSA的疗效与安全性。
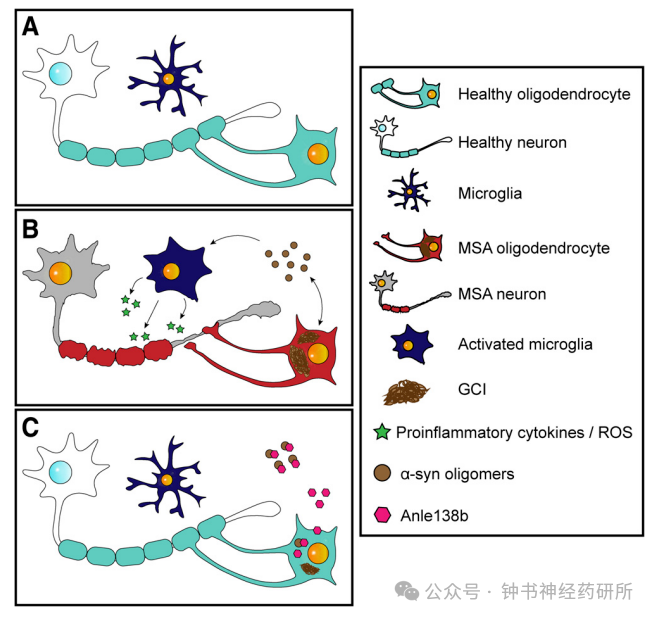
Emrusolmin通过靶向MSA的主要病理标志物之一α-突触核蛋白来发挥潜在的治疗作用,既往一项在MSA小鼠模型中进行的临床前研究显示:
Emrusolmin显著降低小鼠脑内α-突触核蛋白寡聚体的水平,经过治疗后的小鼠在运动协调和平衡能力方面表现更好,运动功能衰退显著减缓。
此外,Emrusolmin可潜在减少神经元和少突胶质细胞的丢失,显示出可能的神经保护作用。
已完成的2项1期临床研究,包括在健康受试者中进行的1a期研究和在帕金森病(PD)患者中进行的1b期临床研究表明,Emrusolmin持续给药 7-28 天是安全且耐受性良好的。
在PD患者中的药物暴露量高于动物模型中观察到的最低有效血浆水平。
基于临床前和临床1期研究数据,Teva于2024年10月启动了一项在MSA患者中开展的2期临床研究(TOPAS-MSA)。
该研究计划在全球约50家临床中心纳入约200例MSA患者,预计2027年6月初步数据读出。
主要终点为治疗48周后,与安慰剂相比,Emrusolmin治疗患者修订统一多系统萎缩量表( UMSARS)第一部分评分较基线的变化值。

多系统萎缩是一种毁灭性、快速进展的神经退行性疾病,目前尚无治愈方法,”Teva全球研发执行副总裁兼首席医学官Eric Hughes博士表示。
“emrusolmin所展现出的潜力,正是Teva正在构建的以患者需求为核心、通过战略合作推动创新的研发管线的有力证明。”
主要参考资料:
1.https://www.tevapharm.com/news-and-media/latest-news/tevas-emrusolmin-granted-u.s.-fda-fast-track-designation-for-treatment-of-multiple-system-atrophy
2.https://www.tevapharm.com/news-and-media/latest-news/teva-and-modag-announce-licensing-collaboration-for-neurodegenerative-disease-drug-candidate/
3. https://clinicaltrials.gov/study/NCT06568237
4.Heras-Garvin A, et al. Anle138b modulates α-synuclein oligomerization and prevents motor decline and neurodegeneration in a mouse model of multiple system atrophy. Mov Disord. 2019 Feb;34(2):255-263.
声明:本文图片和内容主要来自官方和新闻网站,以及公开发表的学术会议或文献信息,如涉及版权问题,请联系删除。本文内容仅供信息分享和学术探讨之用,不构成任何形式的医学建议或健康指导。