近日,Sarepta Therapeutics宣布其与罗氏(Roche)联合开发的基因疗法Elevidys(delandistrogene moxeparvovec,SRP-9001)的生物制品许可申请(BLA)的疗效补充文件已获美国FDA接受并授予优先审评资格,PDUFA日期为2024年6月21日。
去年6月,Elevidys获得美国FDA加速批准上市,成为首个用于治疗杜氏肌营养不良(DMD)4-5岁患者的一次性基因疗法。这些患者携带经验证的DMD基因突变,且并没有预先存在阻止该疗法作用的医学原因。

根据新闻稿,这次Elevidys疗效补充申请的目标有两个:
将Elevidys的标签适应症扩展为“Elevidys用于治疗带有经证实DMD基因突变的杜氏肌营养不良患者”。
将Elevidys加速批准转换为完全批准。
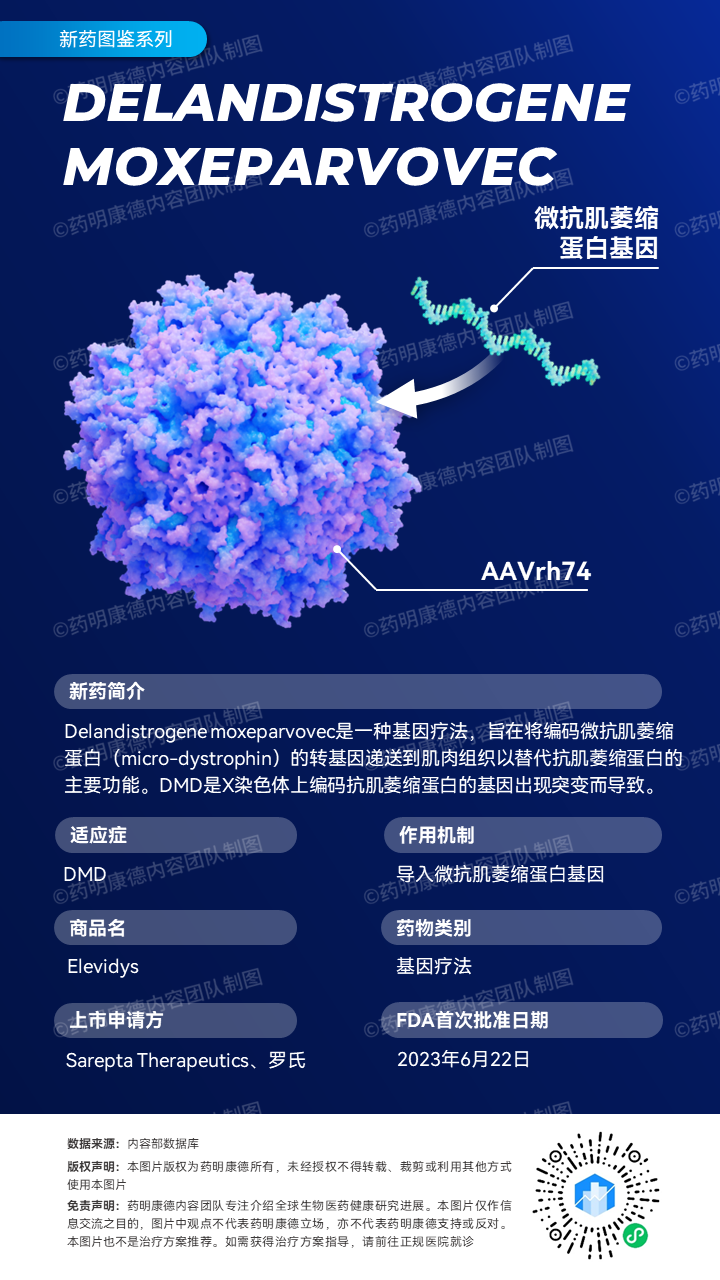
Elevidys是一款重组基因疗法,将表达微抗肌萎缩蛋白(micro-dystrophin)的转基因包装在AAV病毒载体中,通过单次静脉注射,使得患者肌肉生成具有部分抗肌萎缩蛋白功能的重组蛋白,可以对携带任何类型DMD致病基因变异的患者生效。罗氏在2019年与Sarepta达成28.5亿美元的研发合作,共同开发这一基因疗法。
DMD病理过程中的关键蛋白——抗肌萎缩蛋白的编码基因尺寸巨大,这对基因疗法的递送提出了技术挑战。Elevidys所表达的微抗肌萎缩蛋白是一种缩短的功能性抗肌萎缩蛋白,克服了因载体载荷有限所造成的限制,并且能够在肌肉中引起转基因的强力表达。这种疗法使用了从非人灵长类动物中分离出的AAVrh74病毒载体进行递送,不会穿过血脑屏障进入中枢神经系统。而且,较少患者体内存在针对这一病毒载体的免疫力。