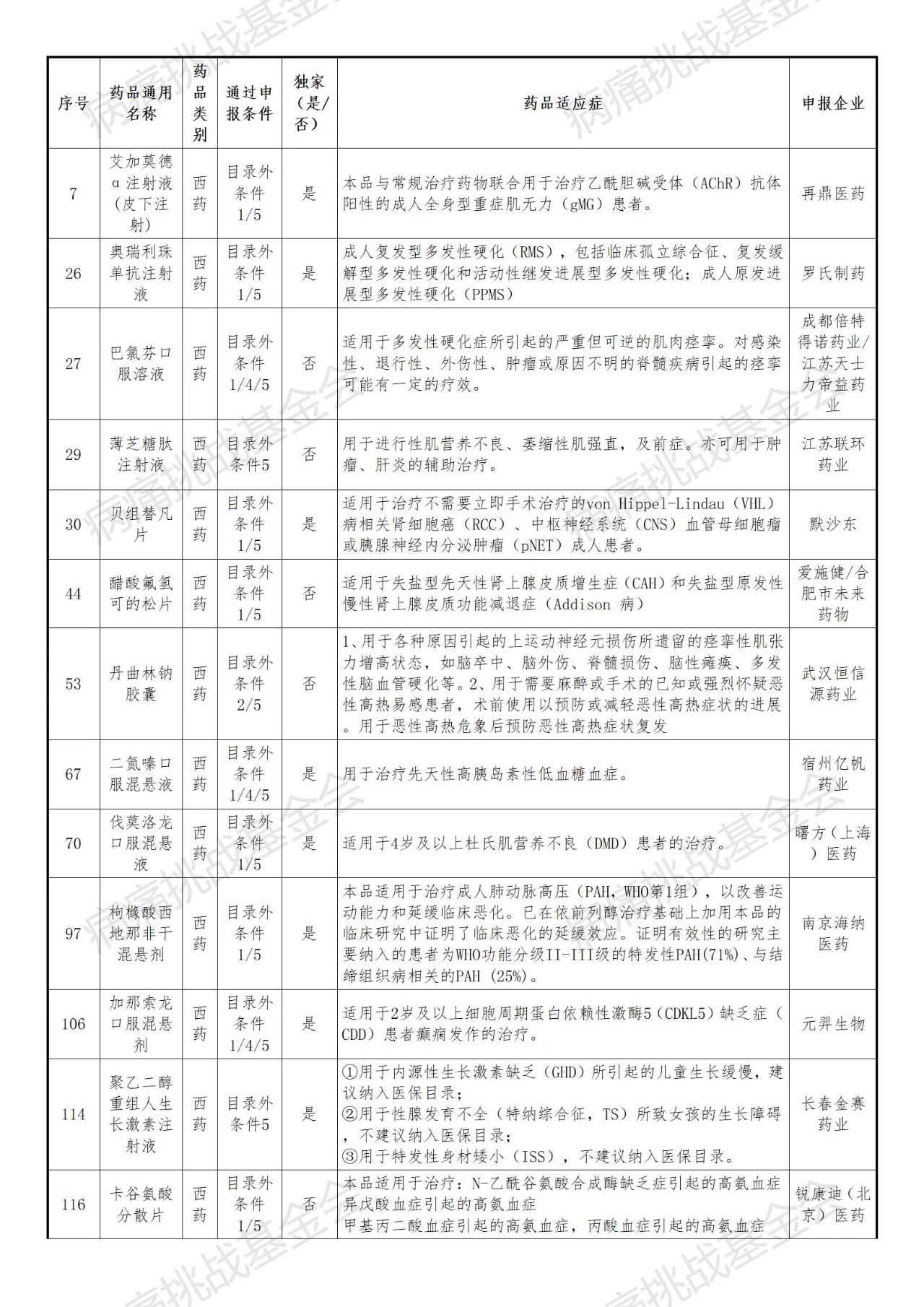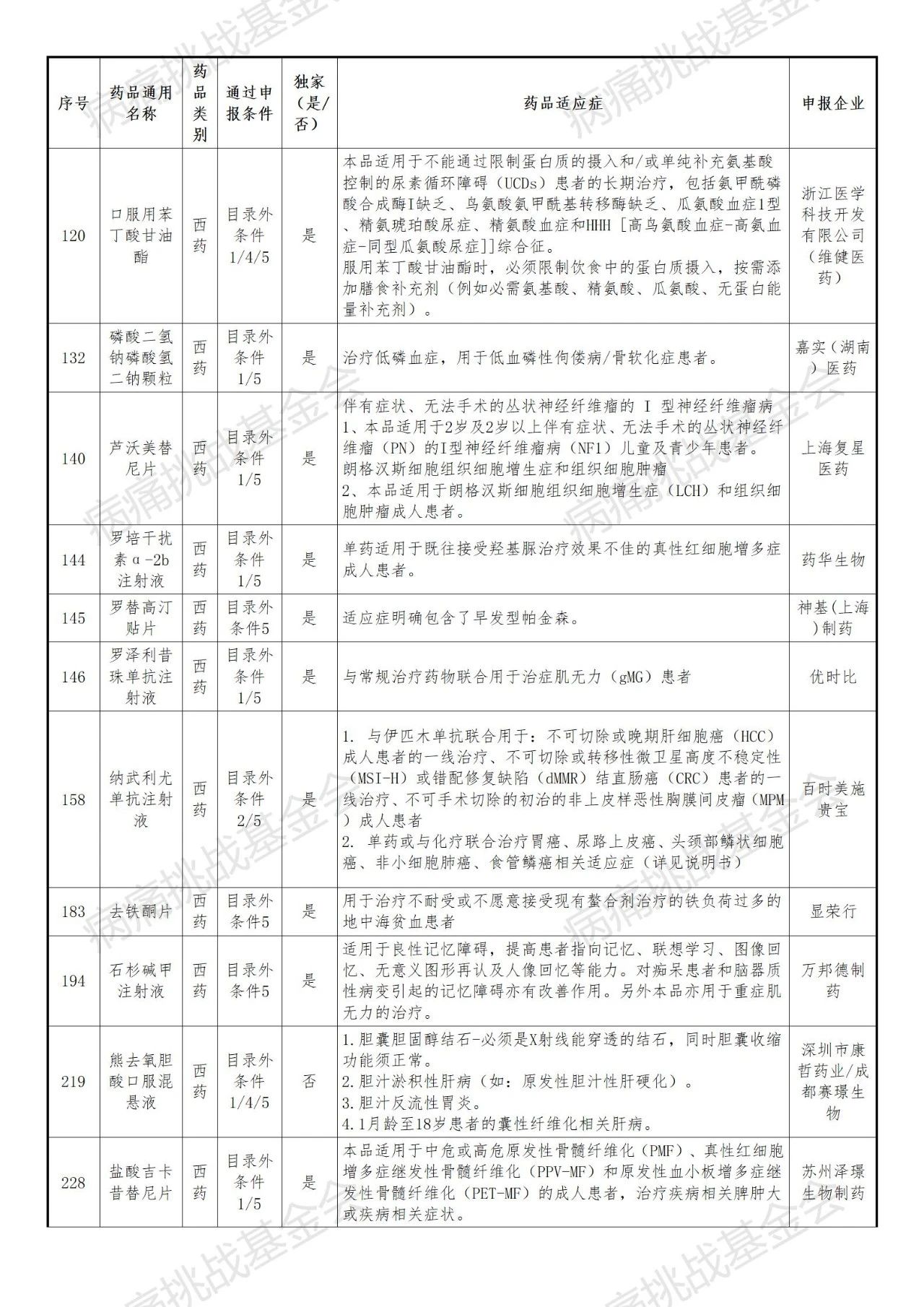
刚刚,国家医保局正式公布了2025年通过形式审查药品名单,其中53种罕见病药品通过初审(名单及药品适应症等信息后附)。
根据初审名单总结来看,罕见病药品有5点值得关注,也期待这些药品能在后续有好的表现,成功进入医保、商保创新药目录,惠及罕见病患者。
五大关注点:
1. 跨国药企与本土创新药企并存,独家品种占比高
国际医药巨头如罗氏、默沙东、百时美施贵宝、阿斯利康、诺和诺德、武田等多款产品入围。本土创新企业(再鼎医药、北海康成、曙方医药、维健医药、嘉实医药等)数量显著,尤其在罕见病儿童用药领域表现突出。独家药品的比例高再次体现罕见病创新药的市场稀缺性。
2. 高价生物制剂的占比较大,基因治疗试水商保创新药目录
单抗(如纳武利尤单抗、伊匹木单抗、艾美赛珠单抗等)、酶替代治疗(ERT)、基因靶向小分子等明显多于传统小分子化药。血友病B型的1类新药、基因疗法波哌达可基注射液也通过商保创新目录初审,有望最终进入商保创新药目录。
3. 价格与支付仍具挑战,部分替代/仿制药品存在降价空间
涉及生物制剂、ERT、罕见病靶向药,价格普遍高昂(如戈谢病ERT、血友病因子制剂、免疫检查点抑制剂),通过谈判进入医保潜在压力大。而已有国内替代或仿制的药品,如部分生长激素、免疫抑制剂,或许会在谈判中有更好的表现。
4. 多款药品基本医保、商保创新目录同时申报,跨支付体系的品种多
多款药物同时申报了两个目录(如贝组替凡片、二氮嗪口服混悬液、伐莫洛龙、加那索龙、口服用苯丁酸甘油酯、磷酸二氢钠磷酸氢二钠颗粒、芦沃美替尼、罗培干扰素α-2b、罗替高汀贴片、纳武利尤单抗、去铁酮片、盐酸沙丙蝶呤片、伊匹木单抗、注射用维拉苷酶α等)。而最终进入商保创新目录的药品有助于突破医保支付能力限制,为罕见病患者治疗可及带来机会。
5. 商保创新目录成为极高值罕见病药物的重要通道
部分药品仅申报商保创新目录(如艾度硫酸酯酶β、布罗索尤单抗、达妥昔单抗β、氯马昔巴特、莫格利珠单抗、那西妥单抗、瑞利珠单抗、注射用人干扰素γ、注射用维拉苷酶β、注射用替度格鲁肽等)。这部分药品的核心特征是适应症患者发病率低,患者人口规模小、单人用药成本极高、医保短期内较难全额覆盖,这部分药品商保或慈善援助项目更易切入。
通过2025年国家基本医疗保险 、生育保险和工伤保险药品目录及商保创新药目录调整形式审查的申报药品名单
一、基本目录
(一) 目录外西药和中成药
药品申报条件:
1. 2020 年 1 月 1 日至 2025 年 6 月 30 日(含,下同)期间,经国家药监部门批准上市的新通用名药品,仅因转产、再注册等单纯更改通用名的药品除外。
2. 2020 年 1 月 1 日至 2025 年 6 月 30 日期间,经国家药监部门批准,适应症或功能主治发生重大变化,且针对此次变更获得药品批准证明文件的药品。
3. 2025 年 6 月 30 日前经国家药监部门批准上市,纳入《国家基本药物目录(2018 年版)》 的药品。
4. 2025 年 6 月 30 日前经国家药监部门批准上市,纳入国家卫生健康委等部门《首批鼓励研 发申报儿童药品清单》《第二批鼓励研发申报儿童药品清单》《第三批鼓励研发申报儿童药品 清单》《第四批鼓励研发申报儿童药品清单》《第五批鼓励研发申报儿童药品清单》以及《第 一批鼓励仿制药品目录》《第二批鼓励仿制药品目录》《第三批鼓励仿制药品目录》的药品。
5. 2025 年 6 月 30 日前经国家药监部门批准上市,说明书适应症或功能主治中包含有国家卫生健康委《第一批罕见病目录》《第二批罕见病目录》所收录罕见病的药品。
表1 通过形式审查的目录外药品名单-基本目录