2025年7月12-13日,蔻德罕见病中心与瑞鸥公益基金会在杭州联合主办患者社群推动药物研发赋能会暨全国罕见病患者组织网络年会。
会议以 “患者社群推动自救式药物研发” 为核心,形式与内容有新突破。围绕药物研发全流程设四大主题分享,邀多领域专家参与,通过四个工作坊促进患者与专家深度交流,旨在解决各阶段核心问题,沉淀经验、形成共识、助力行动。
此次赋能会吸引66个疾病的120位代表,含39个患者组织代表。会上特设 “微光博物馆”,参会者的信物成为情感桥梁与对话媒介,传递个体故事的温度与力量。
蔻德罕见病中心将通过连载发布本次赋能会的相关内容,本篇为系列内容14,您可通过文尾[相关阅读]了解本系列全部内容。
张跃《基因与细胞治疗》

浙江大学良渚实验室研究员张跃分享的主题为《基因与细胞治疗》。
浙江大学良渚实验室团队深耕基因治疗领域,聚焦罕见病创新疗法开发与 AAV 载体优化,其研究为遗传疾病治疗提供了全新视角。从基础原理到临床转化,基因与细胞治疗经历了半个多世纪的迭代,正逐步从实验室走向患者。
一基因治疗的底层逻辑:解码遗传信息传递
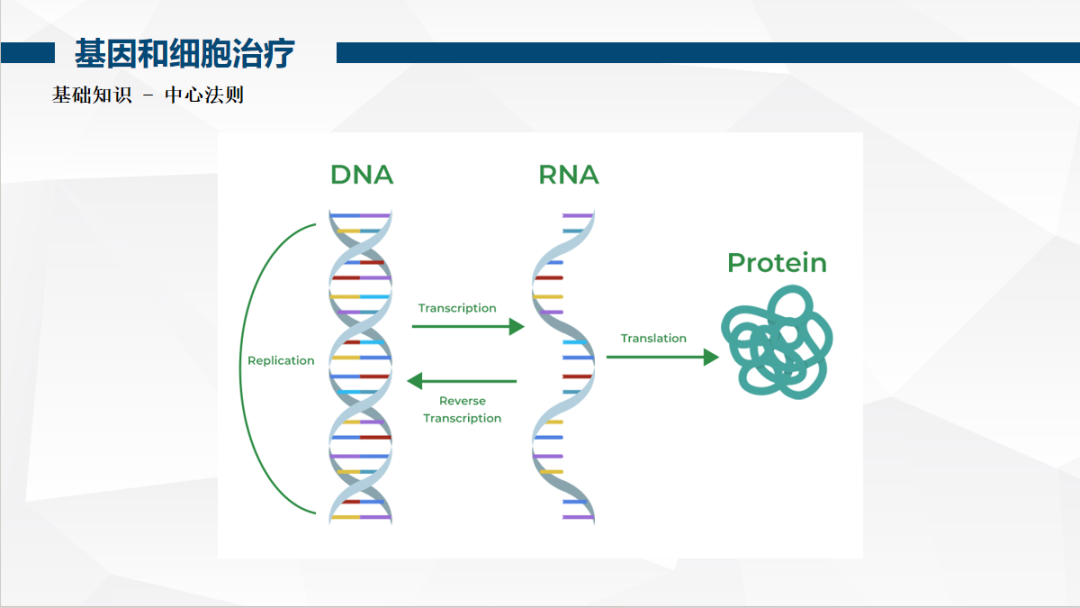
遗传信息通过 DNA→RNA→蛋白质的中心法则传递,任一环节异常均可能导致罕见病。通常来讲,显性遗传疾病中,等位基因中任何一个突变即可致病;隐性遗传则需两个等位基因均突变才发病,这也是近亲结婚增加隐性遗传病患病风险的原因。常染色体遗传疾病男女患病概率均等,而性连锁遗传(如红绿色盲)则呈现明显性别差异。
基因突变类型多样,包括 DNA 层面的碱基替换、插入 / 缺失,蛋白质层面的错误折叠,以及染色体结构、数量异常等。这些变异影响正常生理功能或功能丧失引发疾病,也为基因治疗提供了多个可能的干预靶点。
二技术演进:从概念提出到临床突破
1967 年,科学家首次提出人工合成遗传信息调控细胞功能的设想;1972 年,基因治疗的基本流程(基因递送→转录翻译→功能蛋白表达)被清晰勾勒,奠定了现代基因治疗的理论框架。
1990 年,首个基因治疗临床试验成功用于治疗腺苷脱氨酶缺乏症(ADA-SCID),通过体外改造患者 T 细胞并回输,实现了免疫功能重建。但 1999 年,患者 Jesse Gelsinger因腺病毒载体引发严重免疫反应死亡,导致全球基因治疗研究陷入近十年停滞,却也推动了更安全的 AAV 载体研发。
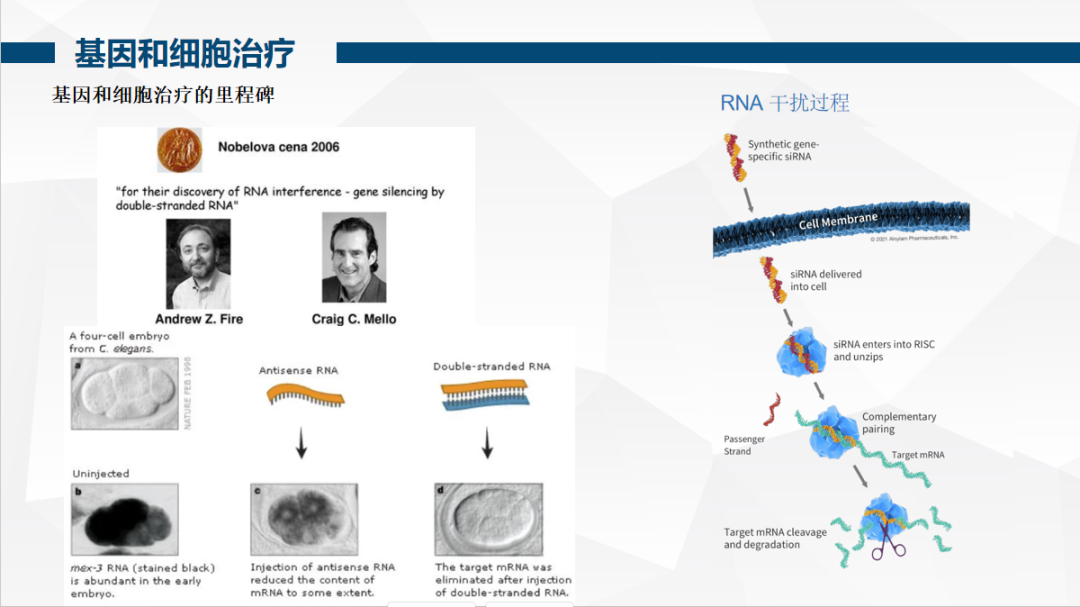
2006 年,RNA 干扰(RNAi)技术获诺贝尔奖,为显性遗传病治疗开辟新路径 —— 通过小 RNA 分子降解异常 mRNA,抑制相应蛋白合成。2012 年,欧洲批准首个基因治疗药物 Glybera(针对 lipoprotein 脂肪酶缺乏症),2019 年诺华 Zolgensma(治疗SMA)以 212.5 万美元定价成为 “最贵药物”,标志着 AAV 载体技术走向成熟。
CAR-T 细胞疗法是细胞治疗的里程碑。通过改造患者 T 细胞使其表达嵌合抗原受体(CAR),可精准识别并杀伤癌细胞。浙江大学黄河团队开发的 “杭州方案” 将终末期血液疾病患者一年生存率提升至 68%,同时开展通用型 CAR-T 研发以降低成本。
三核心技术:基因编辑与递送系统的革新
基因编辑技术历经三代发展:ZFNs 和 TALENs 依赖蛋白识别 DNA 序列,操作复杂;CRISPR/Cas9 通过 sgRNA 精准定位,成本低、效率高,其衍生的碱基编辑器(CBE/ABE)可实现单碱基精准修正,引导编辑(Prime Editing)则能完成插入、删除等复杂操作,脱靶风险更低。2025 年,全球首个个性化碱基编辑疗法仅用 6 个月完成从设计到给药,展现出巨大潜力。
递送系统是基因治疗的 “瓶颈”。AAV 载体因安全性高、组织靶向性强成为主流,但其容量有限(仅能携带约 4.7kb 基因)。张跃团队通过定向进化、AI 辅助设计等手段改造 AAV,提升转导效率与组织特异性。非病毒载体如脂质纳米颗粒(LNP)可重复给药,主要靶向肝脏和肺脏,但其他器官递送的效率有待提高。
四治疗策略与伦理考量
基因治疗策略大致可分为四大类:基因增补(补充正常基因,如 SMA 治疗)、基因沉默(RNAi 降解异常 mRNA)、基因编辑(直接修正突变)、自杀基因(诱导病变细胞死亡)。此外,表观遗传调控通过多种修饰方式调控基因的表达,为遗传疾病基因疗法提供新思路。
伦理问题不容忽视。贺建奎 “CRISPR 婴儿” 事件警示:基因编辑需严守 “治疗而非增强” 底线,需确保知情同意、风险收益平衡及公平性。当前,科研界普遍反对生殖系基因编辑,聚焦体细胞治疗以规避遗传风险。
五中国进展与未来展望
2025 年,中国首款 AAV 基因治疗药物(血友病 B)获批,80 款产品进入临床,50 款 AAV 疗法获 IND 批准。张跃团队开发的丙酸血症基因增补疗法已完成临床前研究,抑制性 tRNA 疗法在黏多糖贮积症模型中显著改善症状。
从实验室到病床,基因与细胞治疗仍需突破递送效率、长期安全性等挑战。但随着技术迭代与伦理规范完善,这场 “遗传革命” 正为罕见病患者带来治愈希望。
蔻德罕见病中心&瑞鸥公益基金会将持续关注和参与推动罕见病患者社群推动药物研发这一议题的工作。如您对这一议题有兴趣,希望参与交流、进行项目合作、提供其他支持等,都可以与我们取得联系,请您留下基础信息,我们会及时与您取得联系,共同为罕见病患者社群早日实现有药可医而努力!
