2025 年 5 月 6 日,FDA 局长 Martin Makary 宣布,任命 Vinay Prasad 博士(医学博士、公共卫生硕士)为 FDA 生物制品评估和研究中心主任。Prasad 是一名血液肿瘤学家,曾任加州大学旧金山分校 (UCSF) 流行病学和生物统计学系教授。今后,作为 CBER 负责人,Prasad 将负责该机构对疫苗和生物制剂的监管,包括细胞和基因疗法。
一个月前,CBER前任主任Peter Marks被迫离职。他在位期间被外界视为“疫苗守门人”以及细胞和基因治疗领域“大幅加速的驱动力”。任职期间,Peter Marks推动了22种基因疗法上市,包括美国首个CAR-T细胞疗法。他还大力推动罕见病药物的加速批准,备受争议Sarepta的杜氏肌营养不良症(DMD)基因疗法Elevidys便是他的大力支持下获批上市。
而Vinay Prasad对该基因疗法获批一直持反对态度,认为药物的成本很高,且具有潜在毒性,临床效益仍然不明确。他主张提高审评标准,尤其是在癌症和罕见病药物获批之前,必须在对照试验中证明有意义的生存或生活质量的改善。
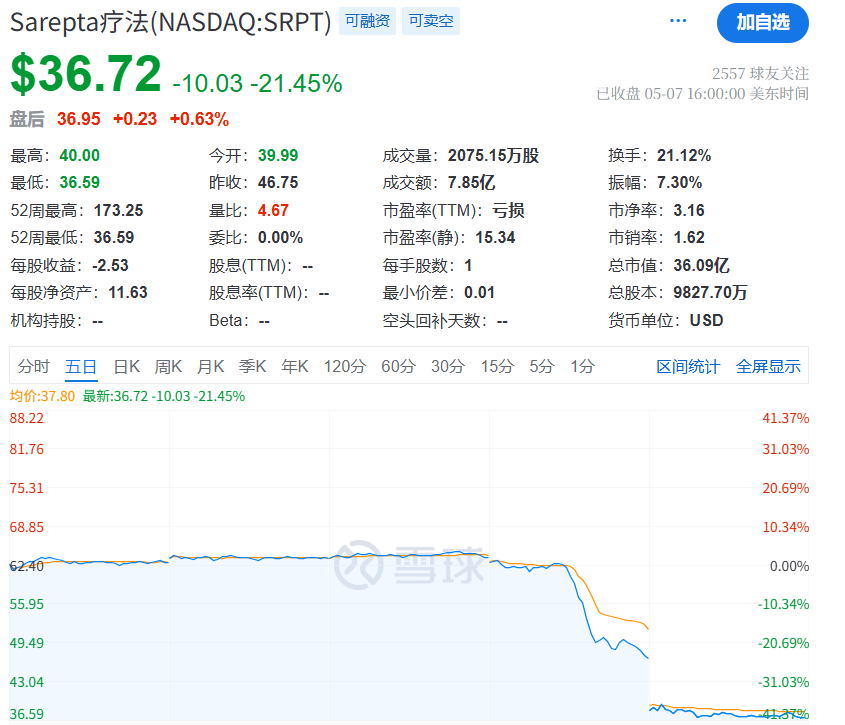
此次CBER高层人事变动,可能预示着美国生物医药监管政策将迎来新一轮调整。受此消息影响,资本市场迅速作出剧烈反应:美国生物科技指数单日跌幅突破5%,疫苗研发及基因治疗领域企业股价普遍承压。
当日,Sarepta Therapeutics日内跌幅达26.56%,盘后交易时段延续跌势;Wave Life Sciences暴跌17.08%、Regenxbio暴跌18.85%、Avidity Biosciences暴跌18.65%、Beam Therapeutics暴跌19.3%、Verve Therapeutics暴跌15.5%等等。
但此前,FDA新局长Marty Makary在接受媒体采访时表示目前正在开发针对罕见病疗法的全新审批路径,即使没有来自随机对照临床试验的数据,也可能允许它们获得批准。
新任命和对未来将出台的政策引发业界对药品审评标准的持续性关注,比起谁来当CBER领导,业界更关关心FDA未来建立制度。