5月12日,MavriX Bio公司宣布,美国FDA已批准其用于治疗AS的腺相关病毒 (AAV) 基因疗法 MVX-220 的临床试验 (IND) 申请。MavriX Bio 预计将于2025 年下半年启动 MVX-220 的“ASCEND-AS”首次人体 (FIH) 临床研究。
MVX-220 由宾夕法尼亚大学开发,并得到了天使综合征治疗基金会 (FAST) 的全力支持,该基金会资助了该项目的开发和非临床研究活动。该项目随后授权给 FAST 药物开发加速器 AS 2 Bio 的投资组合公司 MavriX Bio,以便与专注于开发转化基因疗法并确保全球可及治疗的治疗公司 GEMMABio 合作进行临床转化。
MavriX Bio 表示,将在未来几个月举办一场网络研讨会,提供有关临床试验设计、资格标准和预期时间表的更多详细信息。
此前,据罕见病信息网联合天使综合征之家不完全统计,目前,全球至少有25个项目正处于研发中,多个研发中,进展最快的当属Ultragenyx Pharmaceutical公司开发的GTX-102,这是一款鞘内给药的在研反义寡核苷酸新药,已于2024年5月启动三期临床。
此外,在基因疗法方面,Encoded Therapeutics Inc.公司正在研发基于AAV-9载体的miRNA治疗候选药物。
该药物在诱导多功能干细胞(iPSC)衍生的人神经元中显示出潜在的特异性靶点活性,并在天使综合征小鼠模型中显示出广泛的、剂量依赖性的靶点参与。目前EXT201已经在新生幼猴中进行试验,为期60天的研究中,幼猴耐受性良好,其表达水平持续高于未治疗动物中UBE3A的表达水平。
研究方发布的文章发现支持EXT201作为天使综合征潜在的一次性AAV基因疗法的进一步开发。
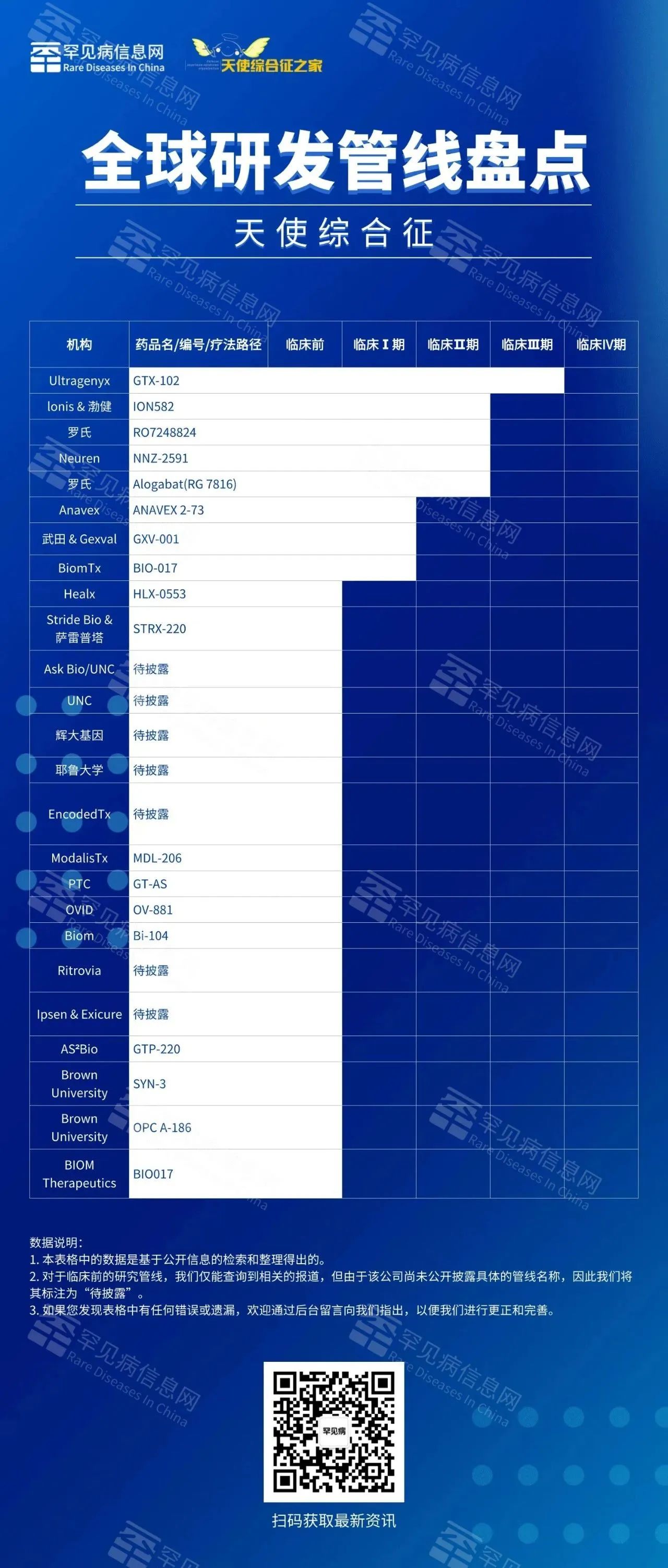
|关于GTX-102研发进展:
1.3期Aspire研究启动:
Ultragenyx Pharmaceuticals宣布,针对天使综合征(Angelman Syndrome)的试验性反义寡核苷酸(ASO)GTX-102的关键性3期Aspire研究已于2024年12月19日开始对首位患者进行了给药。
2.Aurora研究计划:
公司计划在2025年启动Aurora研究,以评估GTX-102对其他天使综合征基因型和不同年龄组的效果。
3.1/2期临床试验数据:
在1/2期临床试验中,接受GTX-102治疗的扩展队列A和B的患者在第170天显示出具有临床意义的多领域功能改善。部分剂量递增队列患者在第758天显示出长期和持续的临床益处,远超过自然历史数据。
这些进展表明,GTX-102的研发正在稳步推进,并且显示出一定的潜力和安全性。
|关于天使综合征
天使综合征是一种罕见的非退行性单基因神经系统疾病,其特征包括严重的发育迟缓、言语障碍、睡眠障碍、癫痫发作、运动和平衡障碍等。该病由神经元中UBE3A基因的功能丧失引起。据估计,天使综合征的发病率为1:12,000-1:20,000。目前尚无获批的天使综合征治疗方法。
|关于MVX-220
MVX-220 是一种在研的hu68AAV基因疗法,旨在通过单次枕大池内注射 (ICM) 将人类UBE3A基因递送至大脑神经元。临床前研究表明,该疗法可恢复 UBE3A 蛋白表达并改善 AS 小鼠模型中的症状。MVX-220 将在 ASCEND-AS(AAV 介导的 Angelman 综合征神经元表达)1/2 期临床试验中进行评估。