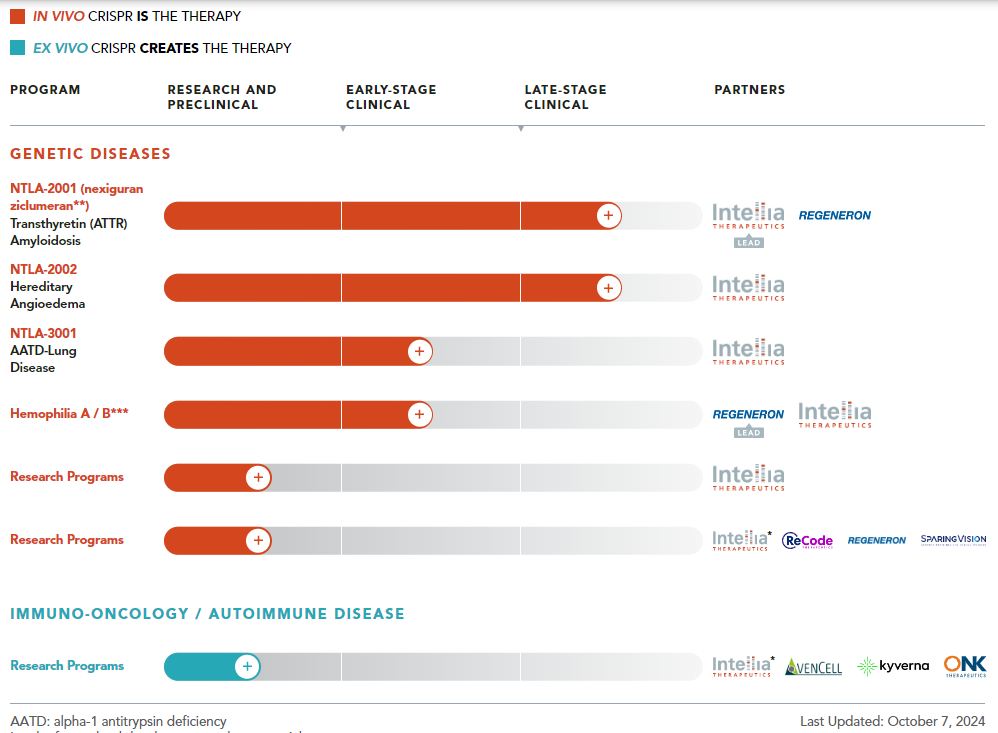
近日,Intellia Therapeutics 向美国证券交易委员会(SEC)提交的文件显示,其与再生元合作开发的核心管线 Nex-z (nexiguran ziclumeran),一款体内基因编辑疗法,在用于甲状腺素转运蛋白淀粉样变性心肌病(ATTR-CM)的 Ⅲ 期临床 MAGNITUDE 中报告了一起 4 级肝转氨酶升高的不良事件。受此消息影响,Intellia 股价在发布后大幅下跌 23% 。
ATTR-CM 俗称 “淀粉人”,患病前期的临床症状与心衰相似,容易误诊和延误治疗,后期出现严重的心脏症状表现后才能被确诊,确诊即晚期,目前确诊患者普遍的生存期为 2-5 年。Nex-z 通过 LNP 技术将靶向 TTR 基因的 CRISPR/Cas9 组合递送至肝脏,对肝细胞内突变的 TTR 基因特定 DNA 进行编辑,以治疗 ATTR-CM 。据悉,该试验已招募 765 名 ATTR 患者,其中 200 名已完成给药。此次出现不良事件的患者入组时转氨酶 (ALT) 和天冬氨酸转移酶(AST)水平正常,输注 nex-z 一周后,ALT 和 AST 水平开始升高,在第 24 天时升级至 4 级,第 28 天达到峰值 。不过,Intellia 表示该不良事件无症状,无需住院或医疗干预,患者肝功能指标随后逐步恢复,截至第 36 天,ALT 和 AST 水平已分别降至 3 级和 2 级。
值得注意的是,对于 ATTR-CM 患者,nex-z 可能与辉瑞的现有标准治疗药物 Vyndamax 联合使用。Vyndamax 通过稳定 TTR 水平发挥作用,而 nex-z 则从基因层面减少 TTR 的产生,从而实现互补疗效。预计招募约 550 名患者,通过评估住院率或死亡率等事件发生时间来衡量疗效。完整试验结果可能在 2029 年公布,但 Intellia 表示,中期积极数据或将提前释放。
此前在 2025 年 5 月 18 日,Intellia 公布了 nex-z 治疗 ATTR 淀粉样变性伴多发性神经病 (ATTRv-PN)Ⅰ 期临床两年的随访数据。结果显示,nex-z 能显著且持续地降低患者的 TTR 水平,同时患者临床症状有所改善。目前,公司已针对该适应症开展 Ⅲ 期临床 MAGNITUDE-2,并预计在 2028 年前提交生物制品许可申请(BLA) 。
目前,ATTR-CM 的治疗费用高昂。辉瑞的 Vyndamax 即将迎来专利到期,届时其价格可能大幅下降。而其他已上市药物如 BridgeBio 的 Attruby 和 Alnylam 的 Amvuttra,年均治疗费用为 25 万至 50 万美元。在 ATTRv-PN 领域,Alnylam 的 Amvuttra、Onpattro 和 Ionis 与阿斯利康联合开发的 Wainua,年治疗费用甚至高达 50 万美元。相比之下,nex-z 作为一次性疗法,尽管单次治疗费用可能更高,但长期来看具备显著的药物经济学优势。Intellia 首席医疗官 David Lebwohl 表示:“即使我们定价在 500 万美元以下,相对于长期使用昂贵药物的总支出,nex-z 依然具有显著的成本优势。我们并不追求创造价格纪录。”
作为基因编辑领域三大龙头之一,Intellia 近年来面临诸多挑战。2024 年 1 月,公司裁员 15% 并停止部分开发项目;2025 年 1 月,再次裁员 27%,同时停止针对 α-1 抗胰蛋白酶缺乏症 (AATD) 相关肺病体内 CRISPR 基因编辑疗法 NTLA-3001 的开发工作 。
目前,Intellia 的首发管线为 TLA-2002,用于治疗遗传性血管性水肿(HAE),旨在利用 CRISPR/Cas9 技术对激肽释放酶 B1 基因(KLKB1)进行基因组编辑,使 KLKB1 失活,降低激肽释放酶活性,以达到治愈疾病的目的。公司预计在 2025 年第三季度完成 TLA-2002 针对 HAE 的 Ⅲ 期临床 HAELO 患者入组,并计划于 2026 年下半年提交 BLA 。
根据 Intellia 2025 年第一季度财报,截至 3 月 31 日,公司拥有现金、现金等价物和有价证券约 7.071 亿美元,预计可维持运营至 2027 年上半年 。然而,此次不良事件的出现,无疑给 Intellia 的发展蒙上一层阴影。在当前严峻的融资环境下,基因编辑技术本就面临诸多质疑,Rocket Pharmaceuticals 实验性基因疗法患者死亡事件更是加重了投资者对安全性的担忧。对于 Intellia 而言,如何平衡创新疗法的疗效与安全性,重拾投资者信心,将是其未来发展的关键所在 。