7月7日,KalVista Pharmaceuticals宣布Sebetralstat(商品名:Ekterly)获FDA批准上市,用于治疗12岁及以上儿童和成人患者的遗传性血管性水肿(HAE)急性发作。该药物是第一个获批用于按需治疗HAE的口服药物。

Sebetralstat是一种新型口服血浆激肽释放酶(PKK)抑制剂,旨在通过抑制因C1酯酶抑制剂(C1INH)蛋白缺乏或功能障碍导致的PKK-激肽系统过度激活来减少全身组织肿胀的发生,从而实现治疗HAE的目的。
FDA此次批准是基于III期KONFIDENT研究的积极数据。结果显示,Sebetralstat(300mg和600mg)组的症状缓解开始时间显著快于安慰剂组(1.61h vs 1.79h vs 6.72h),发作严重程度降低时间快于安慰剂组(9.27h vs 7.75h vs >12h)。此外,Sebetralstat组症状完全消退的时间也更快,300mg和600mg剂量组24h内症状完全消退的患者比例分别为42.5%和49.5%,安慰剂组为27.4%。

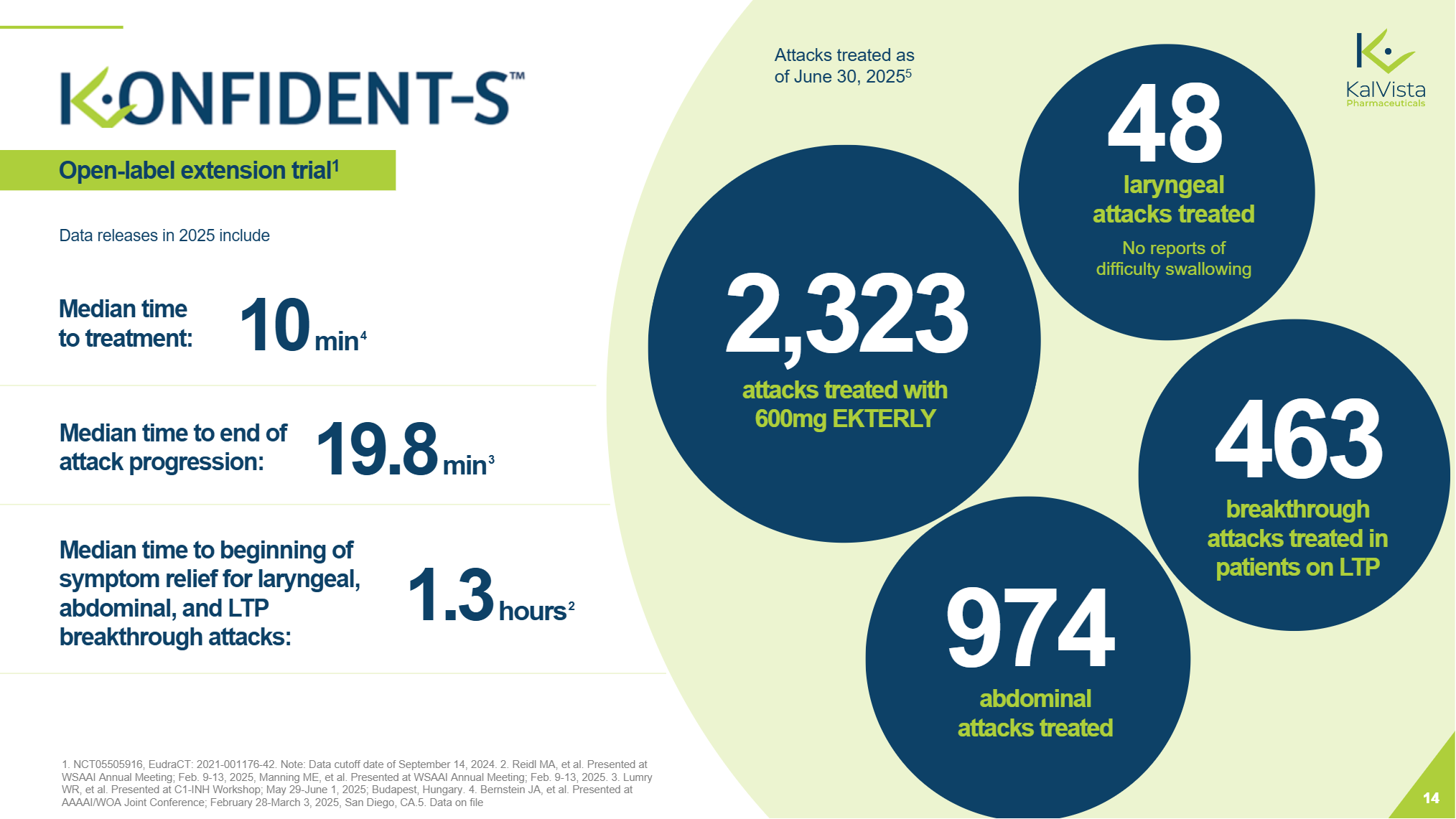
此外,KONFIDENT-S研究显示,患者从HAE发作确认到接受Sebetralstat治疗所需等待的中位时间仅为10min。
在Sebetralstat获批之前,全球已有5款药物获批用于治疗HAE,包括达那唑(赛诺菲)、Berinert(CSL)、艾替班特(武田/赛诺菲)、艾卡拉肽(武田/赛诺菲)、Ruconest(Pharming),但这些药物均为静脉注射或皮下注射制剂。此外,全球共有5款药物用于预防HAE发作,其中仅Berotralstat(BioCryst Pharmaceuticals)为口服药物,但大多数HAE患者在长期预防治疗后仍会继续在不可预测的情况下发作,并且需要接受按需治疗药物治疗。
Copyright © 2025 PHARMCUBE. All Rights Reserved.
欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。