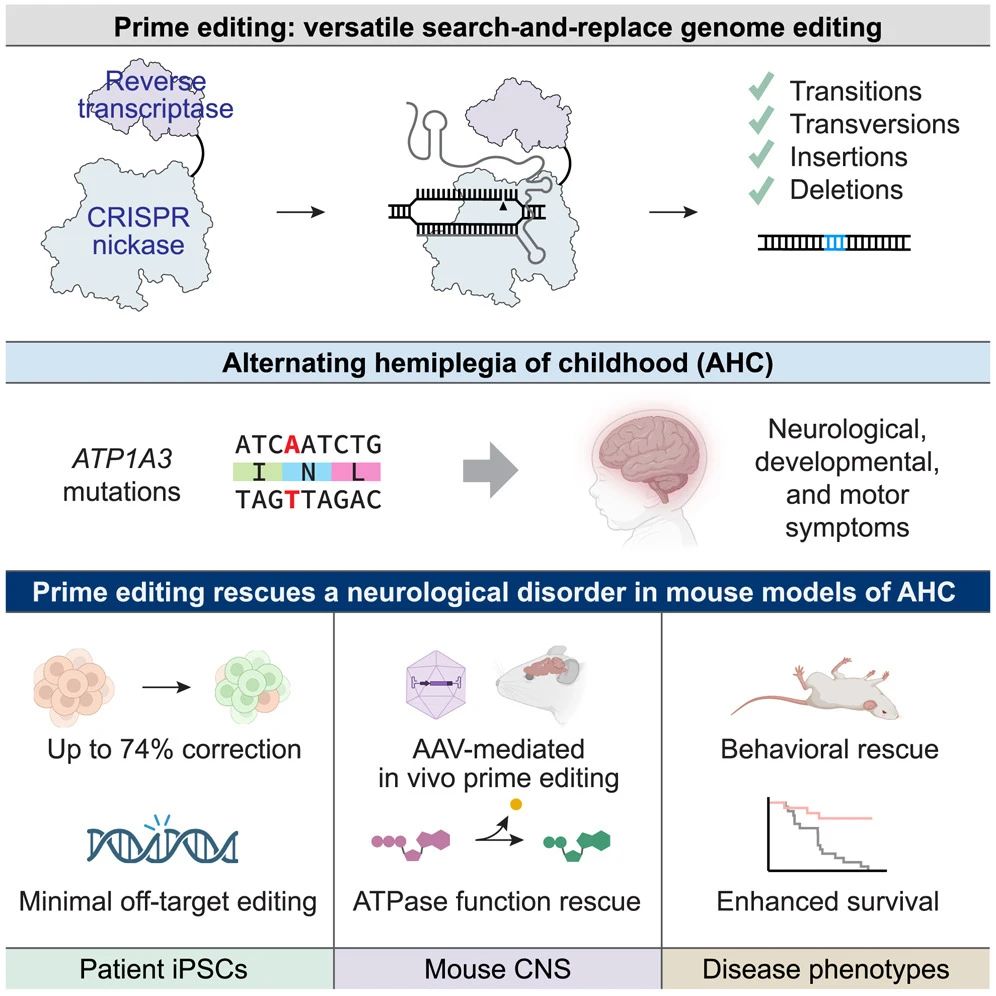
近日,一项基因编辑治疗疾病的重磅成果登上Cell杂志。哈佛大学刘如谦、杰克森实验室Cathleen M. Lutz共同通讯在Cell在线发表题为“In vivo prime editing rescues alternating hemiplegia of childhood in mice”的研究论文,通过单次脑内注射,成功在小鼠模型中实现了儿童交替性偏瘫(AHC)致病基因突变的原位修正,这一突破为这类罕见神经系统疾病的治疗开辟了新路径。

儿童交替性偏瘫是一种极为罕见的遗传性神经疾病,通常在婴儿期就发病。其临床表现为突发性瘫痪发作(可持续数分钟至数日),伴随肌张力障碍、眼球运动异常和发育迟缓;其中最致命的是癫痫发作,可能会导致患儿猝死。目前,全球尚无针对AHC的根治性疗法,现有手段仅能缓解症状,无法阻止疾病进展。
绝大多数AHC病例由ATP1A3基因的4种致病突变之一引发,该基因对脑细胞功能至关重要。
在此项研究中,哈佛大学刘如谦教授团队开创性地同步开发了可修复5种ATP1A3突变的先导编辑治疗方案,其中包括4种最常见的AHC致病突变。多数基因编辑疗法仅针对单一突变进行修正,该研究的研究人员通过同步修正5种突变,不仅优化了实验流程、节约了资源,同时也验证了该技术的普适性。
研究团队采用先导编辑技术来修正AHC模型小鼠的突变。实验数据显示,先导编辑成功修正了小鼠大脑细胞中高达85%的致病突变,不仅恢复了正常蛋白质功能,原本频繁发作的癫痫样症状也大幅减少。此外,接受治疗的小鼠存活时间达到未治疗组的两倍以上,其运动和认知缺陷也明显改善。
虽然现阶段研究对象仅为小鼠,但能在小鼠模型中实现如此高水平的基因矫正,已然具有重大意义。论文中展示了对5种基因变异的矫正效果,这也让研究人员相信,该方法同样适用于其他变异类型。研究团队同时测试了传统基因疗法——即向细胞递送额外的正常ATP1A3基因拷贝,结果发现实验动物的症状并未改善。研究人员指出,这一发现突显了先导编辑技术的独特优势:能够直接修正导致蛋白质功能异常致病的基因突变,从根本上解决致病成因。
在本研究中,基因编辑治疗过程仅需通过单次脑部注射即可完成。研究人员选用了AAV9这一常用于CRISPR基因编辑的无害病毒载体作为递送工具。这类经临床验证的病毒载体已被用于FDA批准的靶向脑细胞的基因疗法,能够突破血脑屏障实现脑内递送。注射在小鼠出生后不久进行,以确保基因编辑工具能在生命早期就作用于大量神经元。此外,研究团队在患者来源细胞中检测到的脱靶效应极低,为该方法的疗效与安全性提供了佐证。
目前,研究团队正重点探索基因编辑干预的最佳时间窗口,他们期望能够在小鼠模型中逆转(而非仅仅预防)AHC症状。团队希望验证在症状显现后——即当小鼠已出现肌张力障碍和癫痫等临床表现时实施治疗的有效性。
论文作者中还包括 RARE Hope 的创始人 Nina Frost,她的女儿 Annabel 在 2 岁时被诊断出患有儿童交替性偏瘫(AHC),此后她创立了 RARE Hope,致力于推动 AHC 研究。Nina Frost 表示,这项研究不仅是 AHC 领域胜利,也是所有罕见神经系统障碍的胜利,更是扩大潜在患者群体可及性的突破性时刻。这是与患者相关、以患者为中心的研究典范,刘如谦团队将我们视为真正的合作伙伴。
本文来源:学术经纬、生物世界