2025年7月12-13日,蔻德罕见病中心与瑞鸥公益基金会在杭州联合主办患者社群推动药物研发赋能会暨全国罕见病患者组织网络年会。
会议以 “患者社群推动自救式药物研发” 为核心,形式与内容有新突破。围绕药物研发全流程设四大主题分享,邀多领域专家参与,通过四个工作坊促进患者与专家深度交流,旨在解决各阶段核心问题,沉淀经验、形成共识、助力行动。
此次赋能会吸引66个疾病的120位代表,含39个患者组织代表。会上特设 “微光博物馆”,参会者的信物成为情感桥梁与对话媒介,传递个体故事的温度与力量。
蔻德罕见病中心将通过连载发布本次赋能会的相关内容,本篇为系列内容10。
任倩倩《希望之光:走进临床试验,了解罕见病治疗的新选择》

泰格医药旗下泰源医药创新研究院投资经理任倩倩带来了《希望之光:走进临床试验,了解罕见病治疗的新选择》的主题演讲
通俗地见解讲解了在临床研究中的主要概念,包括注册临床研究的定义,阐释了从I期到Ⅳ期临床研究的特点,还讲解了研究者发起的研究(IIT)的概念和现状。此外,还带领大家简单学习了临床试验的设计原则和罕见病临床研究的特点,介绍了患者如何通过自身情况,综合判断是否参与以及如何参与临床研究,并介绍患者在临床研究中所需要经历的流程,最后还分享了三个罕见病患者在临床研究中被治愈的案例

注册临床试验是新药、新疗法在人体中进行的系统性研究,包括患者和健康人群,其目的是为了验证安全性和有效性,最终获批上市。注册研究一般需要完成完善的临床前药理、毒理、药效一系列的研究。IIT的要求相对简单,前期有一定的安全性数据就能被各医院的伦理委员会批准开展。目前在我国,很多针对罕见病或者急危重病的细胞基因的疗法往往就是从IIT研究做起。IIT研究在监管方面相对宽松,为我国在细胞基因治疗及早惠及患者以及帮助药企在早期决策研究是否继续开展提供了更加灵活的容错机制。

I期临床研究主要是在健康人群中进行安全性探索,但是细胞基因治疗和肿瘤药在I期研究中,往往入组的是患者。Ⅱ期阶段主要目的是探索剂量和初步疗效,受试者数量一般在100-300例。Ⅲ期阶段为确证性研究阶段,将进一步确证药物的疗效和安全性,一般会选择阳性药物或安慰剂对照,样本量在300例或以上。临床试验的设计三大原则——随机化、盲法和重复原则。一般临床研究要有足够的样本量,但在罕见病的临床研究中,考虑到发病率较低,因此监管机构允许采用较小样本量。
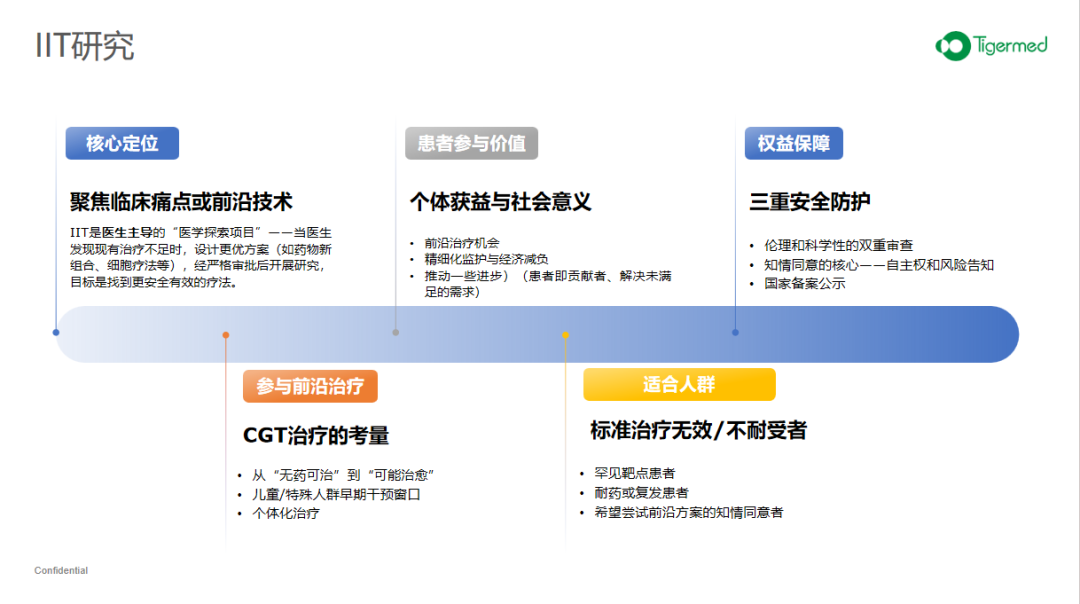
IIT研究相对灵活,其主要受临床医生主导,也有企业资助的项目。IIT研究主要是临床医生在现有治疗手段存在不足的时,尝试设计更优的治疗方案。治疗罕见病的不少细胞基因疗法是以IIT开始进行人用研究,IIT研究对于患者本身有较大的参与价值,不仅可以得到比较前沿的治疗机会,也可以减免部分治疗费用。
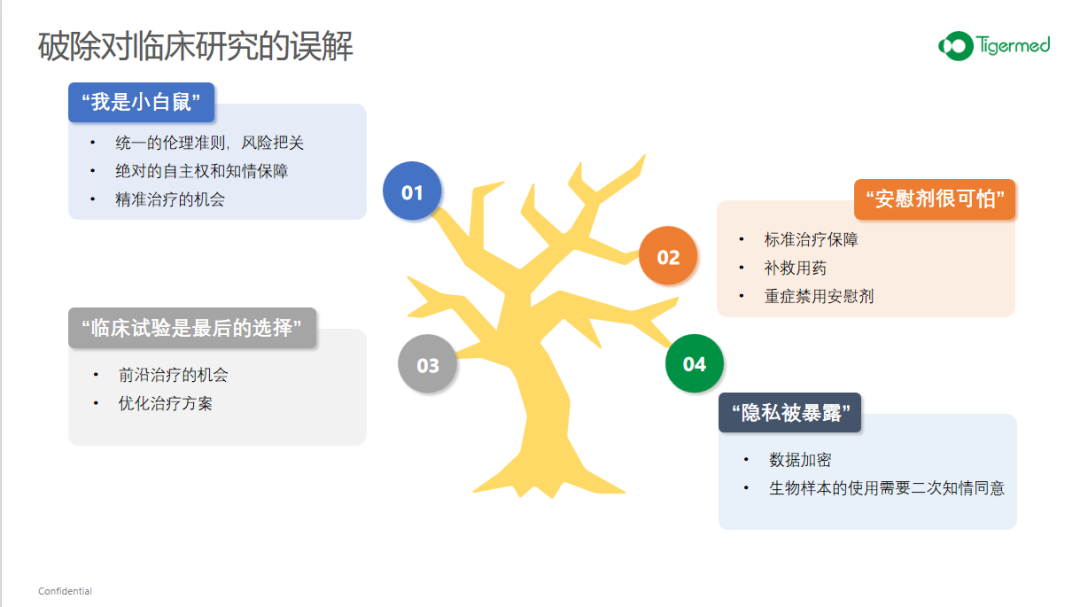
临床研究的总体宗旨是以患者为本,以临床价值为导向。所以患者在临床研究中的权益,无论是知情权还是隐私权还是安全,以及自主的退出权以及补偿权,基本能得到保障。由于药品需有初步安全性数据才能被允许进入临床研究,因此患者在临床研究中绝非“小白鼠”。此外,无论是注册研究还是IIT研究,都会有严格的伦理审查。
患者参加临床试验,很多时候可以获得一种前沿的治疗机会,或者也可能是一种优化的治疗方案,建议综合考虑自身情况以及临床医生的建议决定是否参加。任老师分享了AP4M1基因导致的神经退行性疾病、婴儿鞘磷脂累积、新生儿代谢病脑损伤三个罕见病案例,向大家展示了患者参与临床研究之后疾病治愈的案例,也借这些案例展示了医药企业、临床医生和罕见病患者和共同携手攻克疾病的范本并表达了希望自己将来在罕见病领域投入更多努力的愿望。