汤森路透数据表明,2001-2010年间,孤儿药市场的增长率为25.8%,相对非孤儿药市场的20.1%呈显著优势。而2018年,孤儿药市场规模预计将增长到1270亿美元,复合增长率在2012年到2018年间将达到7.4%,是全球处方药市场(不含通用名药物)增长率的2倍。彼时,孤儿药的市场份额将占到全球处方药市场的15.9%,而1998年时该数字仅为5.1%。
确实,孤儿药单品市场规模虽小,但由于针对特殊人群,因此竞争程度低,准入门槛相对较高,盈利能力也更强。尽管不大可能成为销售额高达上百亿美元的重磅药物,但在这个重磅药物时代即将结束的时候,对于制药企业来说,孤儿药市场的高增长率无疑对其有着巨大的诱惑力。毕竟,随着重磅药物开发策略不再流行,解决真正的临床需求已成为许多大型制药企业新的研发思路。
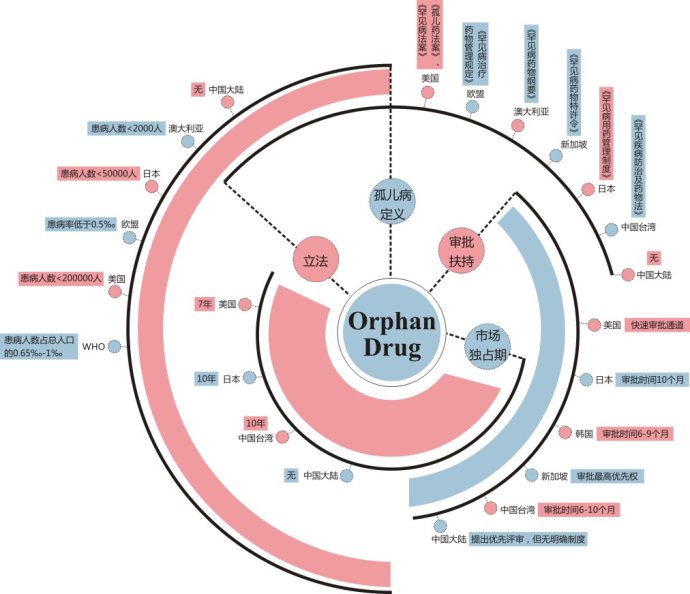
与此同时,为鼓励企业研发生产孤儿药,世界各国普遍对孤儿药的研发销售制定了相应的激励法规政策,如在美国,孤儿药的上市不但享有快速审批通道,并且一旦上市就有7年的市场独占期(无论是否有有效的专利保护)。在此背景下,原来少有制药企业关注的孤儿药成为了制药行业目前最炙手可热的领域之一,跨国巨头纷纷抢滩孤儿药市场。
令人遗憾的是,尽管孤儿药已成为国际“香饽饽”,在我国却依然是“狗不理”——由于市场小,研发费用高,投入与收益不符,且我国在孤儿药的研发、引进、生产及销售等环节都缺乏政策支持,企业大多不愿在相关领域开展研发。因此,我国对孤儿药的研发几乎空白,只能依赖全进口。目前,我国大陆上市的孤儿药仅有130种,只有57种进入了国家医保目录,但我国各类罕见病患者约有1680万人。
显然,我国亟需出台相应的孤儿药研发销售的激励法规政策。目前,我国药监部门虽已建立药品的特殊审评程序,药企可借此享受减免临床试验病例数、快速审批等优惠政策,但因无明确细则出台,具体落实效果尚有待商榷。
对此,专家建议,我国应尽快制定“罕见病法”,完善孤儿药特殊上市保障制度的相应配套制度,对急需孤儿药设立快速审批通道,给予孤儿药生产、引进者相应的市场垄断权、新药定价、税收优惠等,并严格执行药品的再审查制度,以提升药品安全性的保障等。
同时,还需加大孤儿药的基药目录、医保目录覆盖率,提高孤儿药的可及性。